Fiocruz: casos de síndrome respiratória grave atingem patamar estável

A tendência de alta nos casos de Síndrome Respiratória Aguda Grave (SRAG) pode ter sofrido uma interrupção, segundo o mais novo Boletim InfoGripe, divulgado hoje (22) pela Fundação Oswaldo Cruz. O estudo inclui dados da semana epidemiológica 24, que vai de 12 a 18 de junho.

A Fiocruz avalia que, apesar de os números permanecerem altos se for observada a tendência das últimas seis semanas, os dados recentes apontam um patamar estável no número de novos casos, o que caracteriza a formação de um platô.
O boletim é o segundo divulgado pela Fiocruz nesta semana, já que ontem (21) a fundação publicou análise de dados que abarcavam até a semana epidemiológica 23, de 5 a 11 de junho.
Assim como o relatório de ontem, o estudo lançado hoje aponta aumento da participação do SARS-CoV-2 entre os casos de SRAG com teste positivo para vírus: da semana epidemiológica 23 para a 24, essa participação subiu de 71,2% para 80,6%. Já entre os óbitos por SRAG, o coronavírus responde por 94% dos casos quando são considerados apenas as mortes causadas por vírus respiratórios.
Para o coordenador do InfoGripe, Marcelo Gomes, o quadro de estabilização no número de novos casos de SRAG deve ser encarado com cautela e requer mais dados para que seja confirmado.
“Embora ainda apresentem sinal de crescimento na tendência de longo prazo, os estados das regiões Sudeste e Sul dão sinais de possível interrupção nesse aumento de casos, com formação de platô nas primeiras semanas de junho. Como tivemos o feriado prolongado na última semana, pode ter algum impacto nos registros, por isso a cautela e necessidade de aguardar as próximas atualizações para confirmação do cenário”, disse o pesquisador à Agência Fiocruz de Notícias.
A tendência de alta na análise das últimas seis semanas se mantém em 13 das 27 unidades da federação: Acre, Amapá, Ceará, Distrito Federal, Goiás, Mato Grosso, Minas Gerais, Paraíba, Rio Grande do Norte, Rio de Janeiro, Rondônia, Santa Catarina e São Paulo.
A mesma situação é verificada em 16 das 27 capitais: Belo Horizonte (MG), Brasília (DF), Cuiabá (MT), Fortaleza (CE), Goiânia (GO), João Pessoa (PB), Macapá (AP), Natal (RN) Porto Alegre (RS), Porto Velho (RO), Rio Branco (AC), Rio de Janeiro (RJ), Salvador (BA), São Luís (MA), São Paulo (SP) e Teresina (PI).
Diferentemente dos adultos, o cenário entre crianças e adolescentes de até 11 anos é de queda no número de casos. Segundo a Fiocruz, no grupo de 0 a 4 anos, os casos continuam sendo fundamentalmente associados ao vírus sincicial respiratório (VSR), embora também haja presença relevante de SARS-CoV-2 (Covid-19), rinovírus e metapneumovírus.
Edição: Lílian Beraldo


SAÚDE
PAC Saúde: estados e municípios selecionados devem formalizar proposta

Estados e municípios selecionados para receber obras ou equipamentos do eixo saúde do novo Programa de Aceleração do Crescimento (PAC) têm até o dia 10 de maio para preencher as propostas de formalização.

Segundo o Ministério da Saúde, informações adicionais e documentos complementares devem ser apresentados por meio do site do InvestSUS. “A etapa é obrigatória para todos os selecionados, independente da modalidade do Novo PAC Saúde para a qual foi contemplado”, informou a pasta.
Durante a fase de inscrições – entre outubro e novembro de 2023 – os entes federados puderam optar por apresentar alguns documentos posteriormente, desde que assinassem declaração em que atestavam esse compromisso.
Na etapa atual, portanto, estados e municípios devem apresentar, por exemplo, fotos de terrenos e, para alguns tipos de obra, da aprovação do projeto na Comissão de Intergestores Bipartite do Sistema Único de Saúde (SUS).
A expectativa do ministério é que o empenho dos recursos do Novo PAC Saúde para todas as 2.125 obras e os 937 equipamentos previstos estejam prontos até o 30 de junho e que os primeiros repasses sejam feitos ainda em 2024.
Próximos etapas
Após a fase de formalização, o período de análises técnicas está previsto para ser concluído em cerca de 20 dias.
Em seguida, conforme calendário divulgado, virão a assinatura dos termos de compromisso e as transferências fundo a fundo – do Fundo Nacional de Saúde para os fundos de saúde estaduais e municipais.
Novo PAC
Em março, o governo federal anunciou projetos a serem atendidos pelos R$ 23 bilhões previstos no novo Programa de Aceleração do Crescimento (PAC). Na área de saúde, os planos incluem a entrega de 1,8 mil novas Unidades Básicas de Saúde (UBS) e 36 maternidades e 50 policlínicas regionais, além de novas ambulâncias para o Serviço de Atendimento Móvel de Urgência (Samu).
Estão previstas, ainda, a construção de 30 novos centros de parto normal, 150 centros de atenção psicossocial (CAPS) e 20 centros especializados em reabilitação e a aquisição de 400 novas unidades odontológicas móveis e 14 centrais de regulação do Samu.
Fonte: EBC SAÚDE
-

 PLANTÃO POLICIAL6 dias atrás
PLANTÃO POLICIAL6 dias atrásPRF encontra corpo em estado de decomposição às margens da BR-153, em Uruaçu
-

 Acidente5 dias atrás
Acidente5 dias atrásCasal morre em acidente na GO-434 em Rubiataba; Assista
-

 Acidente6 dias atrás
Acidente6 dias atrásJovem cai e morre após levar choque durante serviço, em Crixás
-

 Acidente6 dias atrás
Acidente6 dias atrásAcidente na BR-080 deixa duas vítimas fatais, em Barro Alto
-

 VALE DO SÃO PATRÍCIO5 dias atrás
VALE DO SÃO PATRÍCIO5 dias atrásNova Glória: Corpo de homem é encontrado em residência na zona rural
-

 PLANTÃO POLICIAL6 dias atrás
PLANTÃO POLICIAL6 dias atrásHomem com tornozeleira eletrônica é detido em bar pela PM após causar tumulto, em Ceres
-

 CIDADES6 dias atrás
CIDADES6 dias atrásCâmeras de segurança registra funcionários de hotel sendo agredidos por hóspede, em Caldas Novas; Assista
-
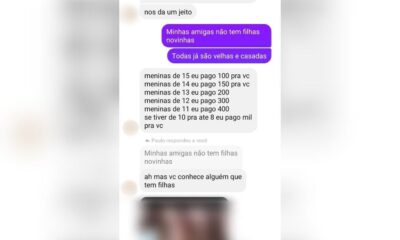
 PLANTÃO POLICIAL6 dias atrás
PLANTÃO POLICIAL6 dias atrásPC realiza prisão de homem por oferecer R$ 1 mil para manter relações sexuais com menores, em Goiás


































